Вследствие участия пары неподеленных электронов атома
азота пиррола в ароматическом сопряжении гетероатом становится более бедным
электронами, поэтому пиррол проявляет слабокислотные свойства. Атом водорода,
связанный с азотом, может быть замещен на металл. Соли образуются только
при взаимодействии со щелочными металлами или с очень сильными основаниями
(с гидроксидами щелочных металлов при высокой температуре, амидом натрия
и др.). Например, пиррол реагирует с металлическим калием с образованием
пиррол-калия:
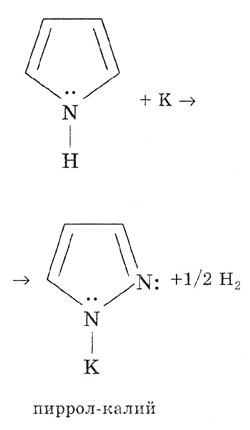
Основные свойства пиррола практически не проявляются из-за участия неподеленной
электронной пары в системе кольцевого сопряжения (пиррольный азот).
Пиррол — бесцветная жидкость, слабо растворима в воде, на воздухе быстро
окисляется и темнеет, tпл
= -23,4°C, tкип
= 130°C, р =
0,97 г/см3.
Название пиррол (красное масло) происходит от старой реакции его открытия,
состоящей во внесении в пары пиррола сосновой лучины, смоченной соляной
кислотой; лигнин древесины окрашивается при этом в красный цвет.
Способы получения пиррола
а) Фуран, тиофен и пиррол могут превращатвся друг в ч друга при нагревании
до 400— 450°C
в присутствии катализатора Аl203
(цикл Юрьева).
|