Гибридизация - это смешивание валентных электронных облаков
и образование качественно новых, равноценных гибридных валентных электронных
облаков.
У атома углерода в возбужденном состоянии 4 валентных электрона
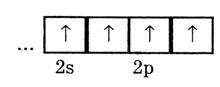
Они неравноценны: s-электрон сферической формы, р-электроны имеют форму
восьмерки и направлены по осям х, у, z.
При образовании химических связей у атома углерода происходит гибридизация.
В зависимости от вида гибридизации атомы углерода могут находиться в трех
валентных состояниях:
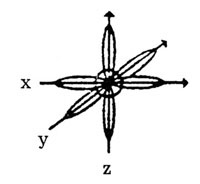
I валентное состояние. Для него характерна sр3-гибридизация.
В случае sp3-
гибридизации образуется четыре гибридных облака, которые направлены из
центра тетраэдра к его вершинам. Угол между осями гибридных электронных
облаков оказывается равным 109°28».
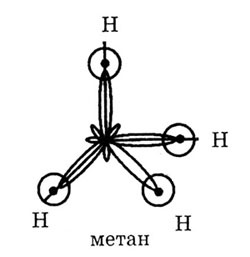
Так образуется метан и его гомологи — алканы с общей формулой
CnH2n + 2.
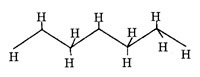
Алканы в пространстве имеют зигзагообразное строение - это ряд тетраэдров,
соединенных своими вершинами:
II валентное состояние - sр2-гибридизация.
Если происходит sр2-гибридизация,
то образуется три гибридных валентных облака, которые лежат на плоскости
под углом 120°.
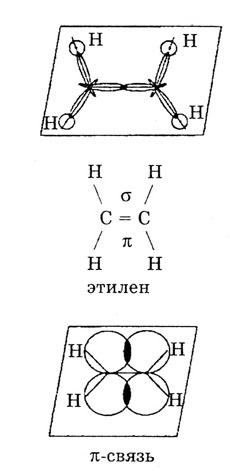
Они образуют на плоскости три сигма-связи. Четвертая связь с соседним
атомом углерода образуется в перпендикулярной плоскости двумя р-электронами,
которые не участвовали в гибридизации. Так образуется этилен и его гомологи
с общей формулой CnH2n.
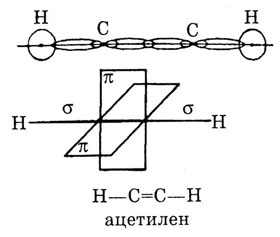
III валентное состояние — sp-гибридизация. В случае sp-гибридизации
образуются два гибридных облака, которые лежат на осевой линии, соединяющей
ядра двух атомов под углом 180°.
Они образуют две сигма-связи по осевой линии — с водородом и углеродом.
2р-электрона, которые не участвовали в гибридизации, образуют с соседним
атомом углерода две П-связи в двух взаимноперпендикулярных плоскостях.
Так образуется ацетилен и его гомологи с общей формулой CnH2n
+ 2.
|