- Положение в периодической системе элементов Д.И. Менделеева, строение
атома, валентность, степень окисления.
- Химические свойства алюминия по отношению:
- а) к простым веществам (2 реакции);
- б) к сложным веществам (3 реакции).
Алюминий Аl находится в третьем периоде, третьей группе, главной подгруппе
периодической системы. Его порядковый номер равен 13. Электронная конфигурация
атома Is22s22p63s23p6.
Электронно-графическая формула внешнего электронного слоя
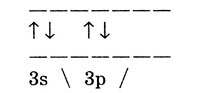
Алюминий имеет постоянную валентность III, в соединениях проявляет степень
окисления +3.
Алюминий — один из самых активных металлов, то есть является сильным
восстановителем. По активности он уступает лишь щелочным и щелочноземельным
металлам.
а) Алюминий окисляется кислородом воздуха уже при обычной температуре.
В результате образуется очень плотная, тонкая защитная оксидная пленка,
которая пассивирует алюминий.
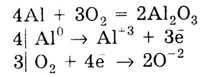
Алюминий реагирует со многими неметаллами:
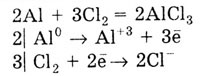
б) Если снять оксидную пленку, то алюминий проявляет присущую ему химическую
активность.
Если погрузить алюминиевую пластинку в раствор соли ртути и процарапать
поверхность пластинки, то в этом месте алюминий вытесняет из раствора
соли ртуть и образует с ней сплав амальгаму. На амальгированной поверхности
оксидная пленка не удерживается. При внесении этой пластинки в воду алюминий
вытесняет водород из воды:
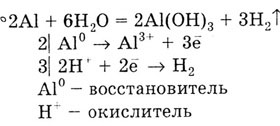
В концентрированных азотной и серной кислотах на холоде алюминий пассивируется.
С другими кислотами алюминий легко взаимодействует, вытесняя водород:
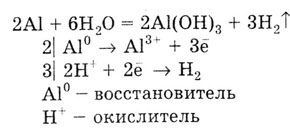
В концентрированных азотной и серной кислотах на холоде алюминий пассивируется.
С другими кислотами алюминий легко взаимодействует, вытесняя водород:
2Аl + 6НСl = 2АlСl3
+ ЗН2
Разбавленная азотная кислота, реагируя с алюминием, восстанавливается
до оксида азота (II):
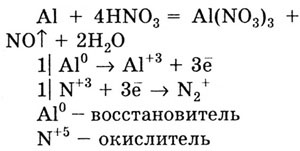
В отличие от щелочных и щелочноземельных металлов, алюминий проявляет
амфотерные свойства, взаимодействуя с раствором щелочи:
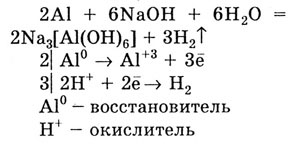
Алюминий восстанавливает многие металлы из их оксидов:
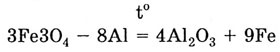
|