Уравнения реакций отношения металлов:
- а) к простым веществам: кислороду, водороду, галогенам, сере, азоту,
углероду;
- б) к сложным веществам: воде, кислотам, щелочам, солям.
- К металлам относятся s-элементы I и II групп, все s-элементы, р-элементы
III группы (кроме бора), а также олово и свинец (IV группа), висмут
(V группа) и полоний (VI группа). Металлы в большинстве своем имеют
на внешнем энергетическом уровне 1—3 электрона. У атомов d-элементов
внутри периодов слева направо происходит заполнение d-подуровней предвнешнего
слоя.
- Химические свойства металлов обусловлены характерным строением их
внешних электронных оболочек.
В пределах периода с увеличением заряда ядра радиусы атомов при одинаковом
числе электронных оболочек уменьшаются. Наибольшими радиусами обладают
атомы щелочных металлов. Чем меньше радиус атома, тем больше энергия ионизации,
а чем больше радиус атома, тем меньше энергия ионизации. Так как атомы
металлов обладают наибольшими радиусами атомов, то для них характерны
в основном низкие значения энергии ионизации и сродства к электрону. Свободные
металлы проявляют исключительно восстановительные свойства.
3) Металлы образуют оксиды, например:
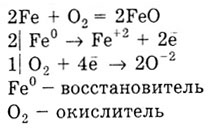
С водородом реагируют только щелочные и щелочноземельные металлы, образуя
гидриды:
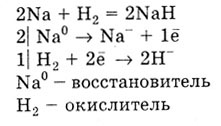
Металлы реагируют с галогенами, образуя галогениды, с серой — сульфиды,
с азотом — нитриды, с углеродом - карбиды.


С увеличением алгебраического значения стандартного электродного потенциала
металла Е0
в ряду напряжений способность металла реагировать с водой уменьшается.
Так, железо реагирует с водой только при очень высокой температуре:

Металлы с положительным значением стандартного электродного потенциала,
то есть стоящие после водорода в ряду напряжений, не реагируют с водой.
Характерны реакции металлов с кислотами. Металлы с отрицательным значением
Е0
вытесняют водород из растворов НСl, H2S04,
H3P04
и т. д.
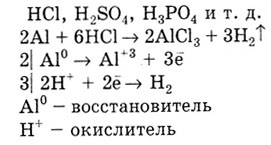
Металл с меньшим значением Е0
вытесняет металл с большим значением Е0
из растворов солей:
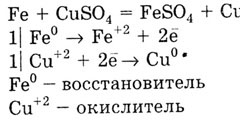
Важнейшие соединения кальция, получаемые в промышленности, их химические
свойства и способы получения.
Оксид кальция СаО называют негашеной известью. Его получают обжигом
известняка СаС03
--> СаО + СО, при температуре 2000°С.
Оксид кальция обладает свойствами основного оксида:
а) реагирует с водой с выделением большого количества теплоты:
СаО + Н20
= Са(ОН)2
(гашеная известь).
б) реагирует с кислотами, образуя соль и воду:
СаО + 2НСl = СаСl2
+ Н2О
СаО + 2Н+
= Са2+
+ Н2О
в) реагирует с кислотными оксидами с образованием соли:
СаО + С02
= СаС03
Гидроксид кальция Са(ОН)2
применяется в виде гашеной извести, известкового молока и известковой
воды.
Известковое молоко — это взвесь, образованная при смешивании избытка
гашеной извести с водой.
Известковая вода — прозрачный раствор, полученный при фильтровании известкового
молока. Используется в лаборатории для обнаружения оксида углерода (IV).
Са(ОН)2
+ СО2
= СаСО3 + Н2О
+ Н2О
При длительном пропускании оксида углерода (IV) paствор становится прозрачным,
так как образуется кислая соль, растворимая в воде:
СаС03
+ С02
+ Н2О
= Са(НСО3)2
Если полученный прозрачный раствор гидрокарбоната кальция нагреть, то
снова происходит помутнение, так как выпадает осадок СаС03:
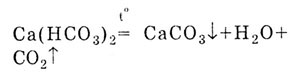
|