Общая характеристика четвертой группы главной подгруппы:
- а) свойства элементов с точки зрения строения атома;
- б) степени окисления;
- в) свойства оксидов;
- г) свойства гидроксидов;
- д) водородные соединения.
а) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ)
— элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое
атомы этих элементов имеют 4 электрона: ns2np2.
В подгруппе с ростом порядкового номера элемента увеличивается атомный
радиус, неметаллические свойства ослабевают, а металлические усиливаются:
углерод и кремний - неметаллы, германий, олово, свинец — металлы.
б) Элементы этой подгруппы проявляют как положительную, так и отрицательную
степени окисления: —4, +2, +4.
в) Высшие оксиды углерода и кремния (С02,
Si02)
обладают кислотными свойствами, оксиды остальных элементов подгруппы -
амфотерны (Ge02,
Sn02,
Pb02).
г) Угольная и кремниевая кислоты (Н2СО3,
H2SiO3)
— слабые кислоты. Гидроксиды германия, олова и свинца амфотерны, проявляют
слабые кислотные и основные свойства: H2GeO3=
Ge(OH)4,
H2SnO3
= Sn(ОН)4,
Н2РЬО3
= Pb(OH)4.
д) Водородные соединения:
СН4;
SiH4,
GeH4.
SnH4,
PbH4.
Метан — CH4
— прочное соединение, силан SiH4
- менее прочное соединение.
Схемы строения атомов углерода и кремния, общие и отличительные свойства.
С lS22S22p2;
Si 1S22S22P63S23p2.
Углерод и кремний - это неметаллы, так как на внешнем электронном слое
4 электрона. Но так как кремний имеет больший радиус атома, то для него
более характерна способность отдавать электроны, чем для углерода. Углерод
— восстановитель:
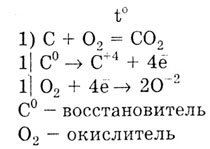
Задача. Как доказать, что графит и алмаз
являются аллотропными видоизменениями одного и того же химического элемента?
Чем объяснить различия их свойств?
Решение. И алмаз, и графит при сгорании
в кислороде образуют оксид углерода (IV) С02,
при пропускании которого через известковую воду выпадает белый осадок
карбонат кальция СаС03
С + 02
= СО2;
С02
+ Са(ОН)2
= CaCO3v
- Н2О.
Кроме того, из графита можно получить алмаз при нагревании под высоким
давлением. Следовательно, в состав и графита, и алмаза входит только углерод.
Различие в свойствах графита и алмаза объясняется различием в строении
кристаллической решетки.
В кристаллической решетке алмаза каждый атом углерода окружен четырьмя
другими. Атомы расположены на одинаковых расстояниях друг от друга и очень
прочно связаны между собой ковалентны-ми связями. Этим объясняется большая
твердость алмаза.
У графита атомы углерода расположены параллельными слоями. Расстояние
между соседними слоями гораздо больше, чем между соседними атомами в слое.
Это обусловливает малую прочность связи между слоями, и поэтому графит
легко расщепляется на тонкие чешуйки, которые сами по себе очень прочные.
Соединения с водородом, образующие углерод. Эмпирические формулы, вид
гибридизации атомов углерода, валентность и степени окисления каждого
элемента.


Степень окисления водорода во всех соединениях равна +1.
Валентность водорода равна единице, валентность углерода равна четырем.
Формулы угольной и кремниевой кислот, их химические свойства по отношению
к металлам,оксидам,основаниям, специфические свойства.
Н2СО3
— угольная кислота,
Н2SiO3
— кремниевая кислота.
Н2СО3
— существует только в растворе:
Н2С03
= Н2О
+ С02
Н2SiO3—
твердое вещество, практически нерастворимо в воде, поэтому катионы водорода
в воде практически не отщепляются. В связи с этим такое общее свойство
кислот, как действие на индикаторы, Н2SiO3
не обнаруживает, она еще слабее угольной кислоты.
Н2SiO3
— непрочная кислота и при нагревании постепенно разлагается:
Н2SiO3
= Si02
+ Н20.
Н2CO3
реагирует с металлами, оксидами металлов, основаниями:
а) Н2CO3
+ Mg = MgCO3
+ Н2
б) Н2CO3
+ СаО = СаСO3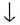 + Н20
+ Н20
в) Н2CO3
+ 2NaOH = Na2CO3
+ 2Н20
Химические свойства угольной кислоты:
- 1) общие с другими кислотами,
- 2) специфические свойства.
Ответ подтвердите уравнениями реакций.
1) реагирует с активными металлами:

Задача. С помощью химических превращений
разделите смесь оксида кремния (IV), карбоната кальция и серебра, последовательно
растворяя компоненты смеси. Опишите последовательность действий.
Решение.
1) к смеси прилили раствор соляной кислоты:

|