Аммиак:
а) эл. строение;
б) химические свойства;
в) способ обнаружения. Н
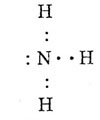
В молекуле ковалентные полярные связи между азотом и водородом.
Валентная структура молекулы:
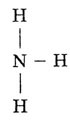
Пространственное строение: молекула аммиака имеет пирамидальное строение.
В вершине пирамиды азот. В углах треугольника, лежащего в основании пирамиды,
атомы водорода.
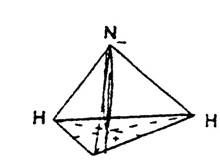
Перпендикуляр, опущенный из вершины пирамиды на основание - это вектор,
показывающий, что молекула аммиака полярна (диполь). Электронная плотность
смещена в сторону более электроотрицательного атома — азота. Поэтому он
заряжается отрицательно.
Аммиак в растворе проявляет основные свойства благодаря наличию у азота
неподеленной пары электронов, с помощью которой к молекуле аммиака притягивается
катион водорода Н+
из воды или кислоты. В результате образуется ион аммония:
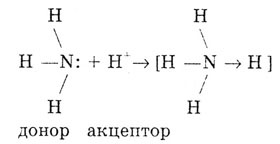
В ионе аммония три связи ковалентные, полярные, одна донорно-акцепторная.
NH3
+ НОН = NH4OH
(гидроксид аммония)
Гидроксид аммония - неустойчивое основание, слабый электролит
NH4OH
= NH3 + НОН;
+ НОН;
NH4OH
= NH4
+ ОН
Под действием гидроксид-ионов ОН-
лакмус приобретает синее окрашивание.
Главная реакция, доказывающая основные свойства аммиака в растворе -
это солеобразование. Аммиак реагирует с кислотами, образуя соли аммония:
NH3
+ HCl = NH4Cl
Так как в молекуле аммиака азот проявляет отрицательную степень окисления
—3, то аммиак является сильным восстановителем в окислительно-восстановительных.
реакциях:

Аммиак можно обнаружить:
- по запаху;
- смоченная водой лакмусовая бумага синеет:
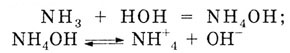
Соли аммония:
- а) общие химические свойства;
- б) особенности химических свойств солей аммония;
- в) качественную реакцию на соли аммония.
Напишите уравнения соответствующих реакций.
а) Все соли аммония являются сильными электролитами и хорошо растворяются
в воде. Они проявляют общие химические свойства, характерные для солей:
взаимодействие с более сильной и менее летучей кислотой:
2NH4Cl
+ H2S04
= (NH4)2SO4
+ 2HCl
H+
+ Cl = HCl;
взаимодействию со щелочью:
NH4Cl
+ NaOH = NaCl + NH3
+ HOH
NH4
+ ОН-
= NH3
+ НОН;
взаимодействие с растворимой солью:
NH4Cl
+ AgN03 =
AgCl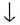 + NH4NO3 + NH4NO3
Ag+
+Сl- =
AgCl;
б) В связи с тем, что в состав солей аммония входит сложный катион NH-4,
соли аммония имеют особенность. Они разлагаются при нагревании по-разному:
соль кислоты-окислителя разлагается с образованием продуктов окисления—восстановления:
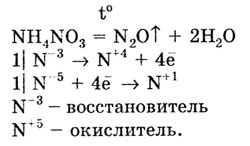
в) Качественной реакцией на соль аммония является взаимодействие со
щелочью. При этом выделяется аммиак, который определяют по запаху или
по синему окрашиванию лакмусовой бумаги, смоченной водой:
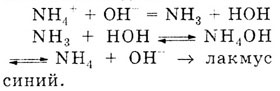
Задача. Напишите не менее четырех уравнений
реакций, при помощи которых образуется оксид азота (II). Укажите окислитель
и восстановитель, уравняйте методом электронного баланса.
Решение.
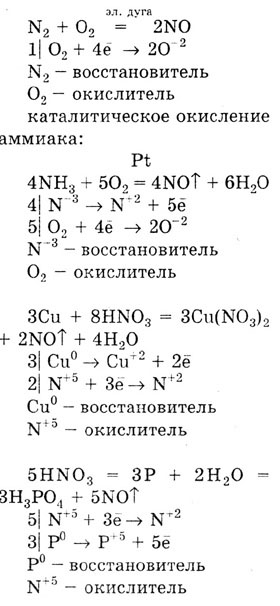
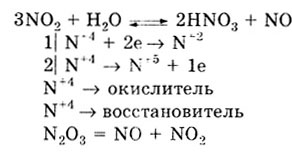
Химические свойства азотной кислоты. Отношение азотной кислоты:
- а) к металлам в зависимости от активности металлов и концентрации
кислоты;
- б) к неметаллам.
а) Азотная кислота является сильным окислителем. При действии ее на
металлы и неметаллы азот со степенью окисления +5 восстанавливается до
различной степени окисления в зависимости от активности металла и концентрации
кислоты.
Концентрированная азотная кислота не действует на Al, Fe, Cr, пассивируя
их. Разбавленная HNO3
реагирует с Al, Fe, Cr, при этом азот со степенью окисления +5 восстанавливается
до +2:
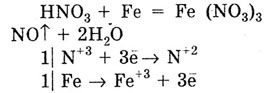
Концентрированная HNO3
с тяжелыми малоактивными металлами (Сu, Hg, Ag, Sn, Pb) реагирует с образованием
бурого цвета N02:
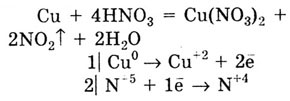
При действии на эти же металлы разбавленной HNO3
выделяется бесцветный газ NO:
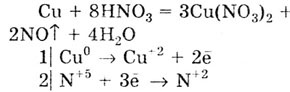
Концентрированная азотная кислота с активными металлами (Ва, Са, Na,
Mg) реагирует с образованием бесцветного газа N2O
или N2:
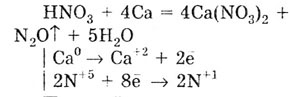
При действии на эти же металлы разбавленной HNO3
выделяется аммиак NH3
(или NH3,N03)
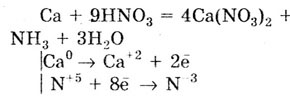
Некоторые неметаллы (J2,
S, Р, С) также окисляются азотной кислотой. При этом концентрированная
азотная кислота восстанавливается до NO2,
разбавленная до NO:
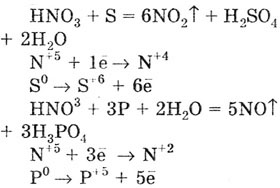
|