Хлороводородная кислота является сильным электролитом.
В растворе она почти полностью диссоциирует:
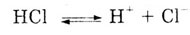
Для нее характерны все общие свойства кислот:
1. Реагирует с металлами, стоящими в ряду напряжений металлов до водорода,
то есть металлы, имеющие отрицательное значение стандартного электродного
потенциала, вытесняют водород из хлороводородной кислоты:
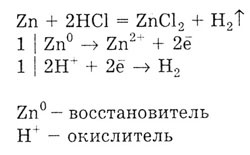
2. Реагирует с оксидами металлов, в результате образуется соль и вода:
СиО + 2НСl = СиСl2
+ Н20
СиО + 2H+
= Си+2
+ Н20
3. Реагирует с нерастворимыми основаниями и со щелочами. Это реакция
нейтрализации. В результате образуется соль и вода:
НСl + NaOH = NaCl + Н20
Н-
+ ОН-
= Н20
2НСl + Сu(ОН)2
= CuCl2
+ 2Н20
2H+
+ Сu(ОН)2
= Сu2
+ 2Н2O
4. Реагирует с солями менее сильных кислот, в результате образуется
новая соль и кислота:
2НСl + Na2CO3
= 2NaCl + Н20
+ СО2
2Н+
+ СO32-
= Н20
+ СО2
В хлороводородной кислоте хлор проявляет отрицательную степень окисления,
поэтому НСl является восстановителем в окислительно-восстановительных
реакциях:
5.

Задача. Почему плавиковую кислоту нельзя
хранить в стеклянной посуде? Напишите соответствующее уравнение реакции.
Решение. Плавиковая кислота HF растворяет
стекло и силикаты, поэтому она не может храниться в стеклянной посуде:
Si02
+ 4HF = SiF4
+ 2Н2О
|