Ряд стандартных электродных потенциалов составлен в порядке
увеличения алгебраического значения стандартных , электродных потенциалов
металлов Е0.
Стандартный электродный потенциал — это потенциал металла, определенный
относительно стандартного (нормального) водородного электрода, при условии,
что концентрация ионов водорода Н+
и ионов испытуемого металла Men+
равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных
электродных потенциалов служит для сравнительной характеристики свойств
атомов и ионов металлов в растворе.
Задача. Напишите уравнение реакции электролиза
расплва КВг.
Решение. В расплаве бромид калия диссоциирует
на ионы
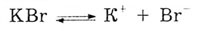
Образующиеся положительно заряженные ионы калия под действием электрического
тока перемещаются к отрицательному электроду(катоду)и принимают от него
электроны (восстанавливаются):
К+
+ е-=
К0.
Отрицательно заряженные бромид-ионы под действием электрического тока
перемещаются к положительному электроду — аноду - и отдают электроны (окисляются):
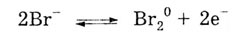 . .
Суммарное уравнение реакции в молекулярном виде:
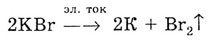
Электролизом расплавов солей получают щелочные и щелочноземельные металлы
в промышленности.
Задача. Какие реакции будут протекать на
электродах при электролизе водного раствора нитрата никеля (II) с инертными
электродами?
Решение. Нитрат никеля (II) — сильный электролит
и диссоциирует в растворе:

Следовательно, в растворе имеется очень много ионов Ni2++,
NO3
и очень мало ионов Н+
и ОН-.
Под действием электрического тока ионы Ni2+
и Н+
двигаются к катоду (—), a N0+3
и ОН-
— к аноду (+). Так как стандартный электродный потенциал никелевого электрода
равен —0,25 В, то на катоде будут протекать параллельно два процесса:
восстановление катионов никеля Ni2+
и 2е-
--> Ni0
и катионов водорода 2Н+
+ 2е-
—> Н20.
У анода скапливаются анионы N0-
и ОН-,
но окислению легче подвергаются гидроксид-ионы: 4ОН-
--> 4е + 2Н20
+ 02.
При протекании на одном из электродов нескольких параллельных процессов
в суммарное уравнение пишут только тот, который протекает преимущественно.
В данном случае не учитывается процесс восстановления катионов водорода,
так как концентрация ионов Н+
в растворе чрезвычайно мала, а концентрация ионов Ni2+
велика, значение электродного потенциала не слишком низкое, чтобы оставаться
в растворе. Поэтому основной процесс на катоде — Ni2+
+ 2е-
—* Ni0.
Суммарное уравнение реакции:
2Ni(N03),
+ 2Н2О
= 2Ni + 02
+ 4HNO3
Задача. Имеется раствор смеси солей: сульфата
натрия, сульфата марганца (II) и сульфата меди (II). Какие вещества и
в какой последовательности выделяется при электролизе этого раствора?
Решение. По ряду стандартных электродных
потенциалов определяем:
E0(Na)
= -2,71 В, Е0(Мn)
= -1,18 В, Е0(Си)
= 0,34 В.
Легче всего на катоде восстанавливаются катионы металлов с наиболее положительным
значением электродного потенциала, т. е. ионы меди (II):
Cu2++
2ё = Сu
Вслед за медью будут восстанавливаться катионы марганца (II), образуя
металлический марганец:
Мn2
+ 2ё = Мn0.
Катионы натрия невозможно восстановить в водном растворе. Поэтому после
окончания восстановления ионов Мn2+
электролизу будет подвергаться вода:
2Н20
+ 2ё --> 20Н-
+ Н2
|