- а) Чем меньше алгебраическая величина потенциала, тем выше восстановительная
способность атомов этого металла. Как следует из ряда стандартных электродных
потенциалов, металлический литий — самый сильный восстановитель в растворе,
а золото - самый слабый.
- б) Чем выше алгебраическая величина потенциала, тем выше окислительная
способность ионов этого металла. Ион Аu3+
— самый сильный окислитель, а ион лития Li — самый слабый окислитель,
и никогда не восстанавливается из раствора.
- в) Все металлы с отрицательными стандартными электродными потенциалами,
т. е. расположенные в ряду до водорода, вытесняют водород из разбавленных
кислот (кроме HN03).
Zn + 2НСl = ZnCl2
+ Н2
Медь не реагирует с соляной кислотой.
- г) Металл с меньшим значением стандартного потенциала вытесняет металл
с большим значением стандартного потенциала из раствора его соли:
Fe + CuS04
= Си + FeS04
Задача. Будет ли цинк взаимодействовать с
водными растворами: а) НС1; б) NiSO4;
в) Mg(N03)2?
Решение. Из ряда стандартных электродных потенциалов находим значение
потенциалов цинкового, водородного, никелевого и магниевого электродов:
Стандартный электродный потенциал цинкового электрода меньше стандартных
потенциалов водородного и никелевого электродов. Следовательно, цинк будет
взаимодействовать с растворами соляной кислоты и сульфата никеля (II):
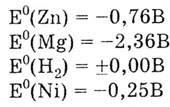 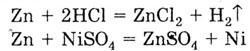
Стандартный электродный потенциал цинкового электрода больше, чем магниевого,
следовательно, цинк не будет реагировать с растворами солей магния.
Электролиз — это окислительно-восстановительные
реакции, протекающие на электродах, если через раствор или расплав электролита
пропускают постоянный электрический ток.
|