Гидролиз солей — обратимый процесс. Для него, как и для
любой другой обратимой реакции, характерно состояние равновесия, которое
может смещаться по принципу Ле-Шателье. Например, если подкислять раствор
соли NH4Cl,
то равновесие сместится в левую сторону, то есть гидролиз замедлится:
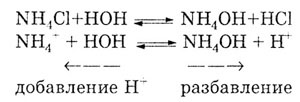
При разбавлении раствора равновесие сместится вправо, то есть гидролиз
соли усилится.
Обратимостьгидролиза солей
Если соль образована cлабым нерастворимым (или летучим) основанием и
слабой летучей (или нерастворимой) кислотой, то гидролиз такой соли идет
до конца. Например, Fe2(C03)3
в растворе не существует, так как полностью гидролизуется:
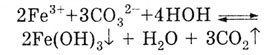
В везультате выпадает осадок бурого цвета Fe(OH)3
и выделяется газ С02.
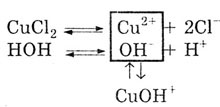
Причиной гидролиза солей по катиону является смещение равновесия диссоциации
воды под действием катионов соли в сторону накопления катионов водорода
Н :
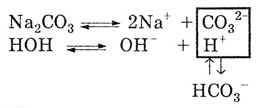
Причиной гидролиза солей по аниону является смещение равновесия диссоциации
воды под действием анионов соли в сторону накопления анионов ОН-:
Причина гидролиза солей по катиону и по аниону.
Так как соль образована слабым основанием и слабой, кислотой, то и катионы,
и анионы соли разлагают воду:
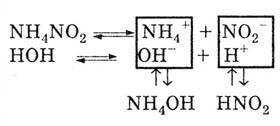
В результате реакция среды или нейтральная, или слабо кислая, или слабо
щелочная. Это зависит от степени диссоциации образовавшихся слабых кислот
и оснований.
Задача. Напишите уравнения реакций гидролиза:
- а) хлорида аммония;
- б) ацетата натрия в молекулярном и сокращенном ионном виде.
Укажите реакцию среды. Как изменится окраска лакмуса в растворах этих
солей?
Решение, а) Хлорид аммония NH4Cl
- соль, образованная слабым основанием NH4OH
и сильной кислотой НСl, гидролизуется по катиону. Сокращенное ионное уравнение:

Чтобы написать молекулярное уравнение, добавляют ионы, которые не участвовали
в гидролизе, но находятся в растворе. Это хлорид-ионы:

Реакция среды кислая. Лакмус становится красным.
б) Ацетат натрия CH3COONa
- соль, образованная сильным основанием NaOH и слабой кислотой СН3СООН,
гидролизуется по аниону. Этот процесс можно выразить сокращенным ионным
уравнением:
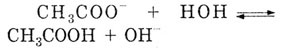
Добавляя недостающие катионы Na+
получают молекулярное уравнение:
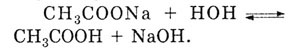
Реакция среды щелочная, лакмус — синий. |