| среда |
нейтральная |
кислая |
щелочная |
| индикатор |
| лакмус |
фиолетовый |
красный |
синий |
| метилоранж |
оранжевый |
розовый |
желтый |
| фенолфталеин |
бесцветный |
бесцветный |
малиновый |
Понятия «сильный электролит» и «сильная
кислота»; «сильный электролит» и «сильное основание».
Если кислота (основание) относится к сильным кислотам (основаниям),
то это значит, что она (оно) практически полностью диссоциирует. Таким
образом, между понятием «сильный электролит» и «сильная
кислота» (основание) существует прямая связь.
Задача. Какой гидроксид является более сильным
основанием:
- а) Ве(ОН)2
или Ва(ОН)2;
- б) NaOH или Аl(ОН)3?
Ответ поясните.
Решение:
- a) Be и Ва находятся во второй группе, главной подгруппе. Но радиус
атома Ва гораздо больше, чем у Be, поэтому связь бария с гидрокси-группой
слабее, чем у бериллия. Следовательно Ва(ОН)2
легче диссоциирует, является более сильным основанием, чем Ве(ОН)2.
- б) Na и Аl находятся в третьем периоде, поэтому радиус атома не влияет
на силу гидроксид ов. В этом случае играет роль величина заряда натрия
и алюминия в гидрокси-де. Чем больше заряд частицы, тем прочнее она
удерживает гидрокси-группу, тем труднее диссоциирует. Заряд натрия +
1, алюминия +3, поэтому NaOH легче диссоциирует, чем А1(ОН)3,
и является более сильным основанием.
Задача. Проведите уравнения реакций между
растворами приведенных веществ (электролитов) и установите общий признак,
по которому можно судить о том, что реакции прошли до конца. Напишите
сокращенные ионные уравнения.
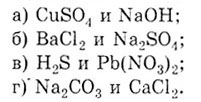
Решение. Все реакции обмена происходят,
так как соблюдены все условия:
а) растворимая соль реагирует со щелочью:
CuSO4
+ 2NaOH = Na2SO4
+ Cu(OH)2 ; ;
Cu2+
+ 20H-
= Cu(OH) ; ;
б) две соли реагируют между собой, если они обе растворимы: ш '•
BaCl2
+ Na2S04
= BaSO4 + 2NaCl;
+ 2NaCl;
Ва2+
+ S042-
= BaSO4 ; ;
в) кислота реагирует с солью менее сильной и более летучей кислоты.
Это общее правило. В данном случае H2S
-слабая кислота, a Pb(N032)2
- соль сильной кислоты. Но, несмотря на это, реакция между ними происходит,
так как PbS — не растворяется ни в воде, ни в кислоте:
H2S
+ Pb(N03)2
= PbS + 2HNO3.
+ 2HNO3.
Так как H2S
— слабый электролит, то ее пишут в молекулярном виде:
H2S
+ Рb2+
= PbS + 2Н+
+ 2Н+
г) Na2CO3
и СаСl2
растворимы в воде, поэтому реагируют:
Na2C032
+ СаСl2
= 2NaCl + CaCO3 ; ;
Са2+
+ С032-
= CaCO3 . .
Общий признак, по которому судят о том, что реакции прошли — выпадение
осадков Cu(OH)2,
BaS04,
PbS, CaC03.
Задача. Проведите реакции между следующими
веществами:
- СиО и H2S04;
- СаС03
и НСl;
- Си(ОН)2
- и HN03.
По какому признаку можно судить, что эти реакции осуществились. Поясните
сущность реакций соответствующими уравнениями в молекулярной и сокращенной
ионной форме. Сделайте вывод о том, чем различается запись ионных уравнений:
- а) между веществами, растворимыми в воде;
- б) между веществами, v одно из которых в воде нерастворимо?
Решение. Все реакции осуществимы. СиО, СаС03,
Си(ОН)2
не растворимы в воде, но растворимы в сильных кислотах:
а) CuO + H2SO4
= CuS04
+ Н20;
СиО + 2Н+
= Си2+
+ Н20.
Черный оксид меди растворяется и образуется голубой раствор CuSO4
окраска которого обусловлена ионами Си2+.
б) СаС03
+ 2НСl = СаСl2
+ Н20
+ С02 ; ;
СаС03
+ 2Н+
= Са2+
+ Н20
+ С02.
Белое твердое вещество СаС03
растворяется в кислоте; выделяется газ С02.
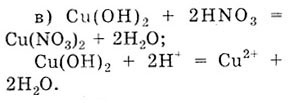
Голубой осадок Си(ОН)2
растворяется в кислоте; раствор становится голубым из-за присутствия в
растворе катионов Си2+.
Вывод. Если реагируют вещества, растворимые
в воде, то их пишут в ионном виде; если одно из реагирующих веществ нерастворимо
в воде, то его пишут в молекулярном виде. Задача. На каждое ионное уравнение
приведите по два примера молекулярных уравнений реакций:
- a) Mg2+
+ 2OH-
--> Mg(OH)2;
- б) 2Н+
+ S2-
--> H2S.
Решение.
а) Необходимо взять хорошо диссоциирующие и хорошо растворимые вещества,
например, соль MgCl2,
которая при диссоциации в растворе дает ионы
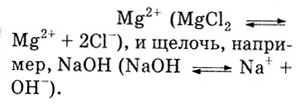
В результате обменной реакции между солью и щелочью выпадает осадок
Mg(OH)2:
MgCl2
+ 2NaOH = Mg(OH)2 + 2NaCl
+ 2NaCl
или:
Mg(N03)2
+ Ca(OH)2
= Mg(OH)2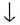 + Ca(N03)2
+ Ca(N03)2
б) Необходимо взять сильную и растворимую кислоту, например, НСl, которая
при диссоциации в растворе дает катионы и хорошо растворимую соль сероводородной
кислоты. В результате обменной реакции образуется малодиссоциирующая летучая
кислота H2S:
2НСl + Na2S
= H2S + 2NaCl
+ 2NaCl
или:
H2S042
+ K2S
= H2S + K2SO42.
+ K2SO42.
Задача. Из перечисленных ниже веществ выделить:
- а) электролиты сильные;
- б) электролиты слабые (и средней силы);
- в) неэлектролиты.
Гидроксид натрия, хлорид натрия, гидроксид аммония, глюкоза, соляная
кислота, уксусная кислота, бензол (С6Н6), вода, ацетат аммония, сахароза
(C12H2O11),
сульфат цинка, этанол (С2Н3ОН),
алюминат калия, сероводородная кислота, гидрокарбонат кальция, азотная
кислота.
Напишите формулы веществ и уравнения диссоциации электролитов.
Решение.
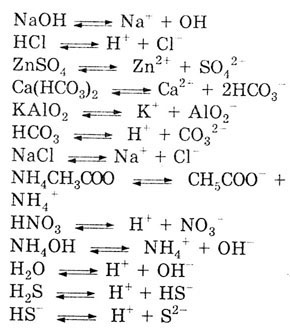
- а) NaOH, NaCl, HC1, NH4CH3COO,
ZnS04,
KAl02,
Ca(HC03)2,
HN03
- сильные электролиты;
- б) NH4OH,
CH3COOH,
H,0, H2S
— слабые электролиты;
- в) глюкоза С6Н12О6,
бензол С6Н6,
сахароза С12Н22О11,
этанол С2Н5ОН
— неэлектролиты.
|