Если на систему, которая находится в состоянии динамического
равновесия, оказывать внешнее воздействие, то в системе будут протекать
процессы, направленные на уменьшение этого внешнего воздействия. Так,
например, если:
- а) повышать температуру, то равновесие сместится в сторону эндотермической
реакции;
- б) понижать температуру, то равновесие сместится в сторону экзотермической
реакции;
- в) повышать давление - равновесие сместится в сторону образования
меньшего числа молекул;
- г) понижать давление — равновесие сместится в сторону образования
большего числа молекул;
- д) увеличивать концентрацию исходных веществ — равновесие сместится
в сторону образования продуктов реакции;
- е) увеличивать концентрацию продуктов реакции — равновесие сместится
в сторону образования исходных веществ.
Задача. Как сместится равновесие реакции

если:
- а) повысить температуру?
- б) понизить температуру?
- в) увеличить давление?
- г) понизить давление?
- д) увеличить концентрацию водорода?
Решение. В соответствии с принципом Ле-Шателье
и с учетом заданных условий в случаеа) равновесие сместится влево; в случаях
б) и в) - вправо; в случае г) - влево (в исходных веществах четыре молекулярных
объема,а в конечных - два); в случае д) равновесие сместится в сторону
синтеза аммиака.
Задача. Во сколько раз возрастет скорость
реакции синтеза аммиака, если концентрацию водорода увеличить в 5 раз?
Решение. Синтез аммиака описывается реакцией:
ЗН2
+ N2
--> 2NH3.
В общем виде скорость этой реакции можно записать:
V = К[Н2]3
• [N2].
Если [Н2]
= а моль/л, a [N2]
= b моль/л, то Y1
= К • а3
• b; при увеличении концентрации водорода в 5 раз скорость реакции станет
равной Y2
= K[5a]3b.
А в целом скорость реакции увеличится во столько раз, во сколько раз v,
больше v, т. е.:
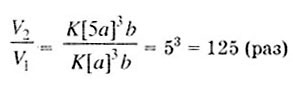
Задача. Какое влияние на равновесное состояние
системы

окажут:
- а) увеличение давления,
- б) повышение температуры,
- в) введение катализатора?
Решение.
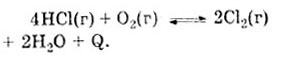
|