Электроотрицательность — мера
способности атома, связанного с другим атомом, притягивать к себе электроны.
В периодической системе с увеличением числа электронов на внешнем электронном
слое слева направо электроотрицательность увеличивается, а сверху вниз
с увеличением радиуса атома электроотрицательность уменьшается.
Ковалентная связь - связь, образованная
двумя или несколькими атомами неметаллов за счет образования общих электронных
пар. Разновидности ковалентной связи: полярная, неполярная донорно-акцепторная.
Неполярная ковалентная связь - образуется
между атомами с одинаковыми значениями электроотрицательности (02,
N2,
H2).
В этом случае электронная плотность симметрична относительно ядер атомов
и дипольный момент равен нулю.
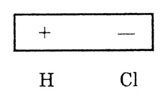
Полярная ковалентная связь — образуется
между атомами с различными значениями электроотрицательности (НСl, H2S,
NH3).
В этом случае общие электронные пары (электронная плотность) смещены к
более электроотрицательному элементу.
В результате возникает электрический диполь:
Донорно-акцепторная связь — разновидность
кова-лентной связи, образующаяся за счет электронных пар одного из атомов
(донора) и свободной орбитали другого (акцептора).
Ионная связь — образуется при помощи электростатического
притяжения ионов металлов и неметаллов (АlСl3,
CuO, FeS). Ее можно рассматривать как предельно поляризованную ковалентную
связь, Зкогда электронные пары, связывающие атомы, полностью перешли к
более электроотрицательному атому.
Водородная связь - это связь, возникающая
между ионом водорода и сильно электроотрицательным атомом (О, F, N и др.),
входящим в состав молекулы. Водородная связь может быть межмолекулярной
и внутримолекулярной.
|