Для изображения конфигурации атома (строения электронных
оболочек) необходимо знать:
- Место элемента в периодической таблице Д.И. Менделеева.
- Общее число электронов в атоме (равно порядковому номеру).
- Максимальное число электронов на уровне (2n2).
- Порядок заполнения электронами подуровней и орбиталей, т. е. последовательность
атомных орбиталей в порядке повышения энергии.
Налрмер: Элемент кислород с порядковым номером 8 находится во втором
периоде (n = 2), в 6 группе, главной подгруппе. Это р-элемент. Ег восемь
электронов распределяются на двух уровнях: первом (К) и втором (L). На
1s и 2s-орбиталях помещается по 2 электрона. Остаются еще 4 электрона,
которые следует поместить на трех 2р-орбиталях. Следуя правилу Гунда,
поместим по одному электрону на каждую 2р-орбиталь.
Четвертый электрон должен быть спарен с одним из трех электронов, уже
находящихся на 2р-орбиталях, поэтому правильная электронно-графическая
формула кислорода имеет следующий вид:
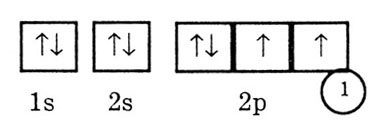
Соответствующая электронная конфигурация записывается в виде 1s22s22p4
или в виде [Не] 2s22p4.
Электроны конфигурации Is2 или [Не] образуют внутреннюю оболочку, или
остов, атома кислорода. Электроны конфигурации 2s~2p находятся на внешней
оболочке и относятся к валентным электронам.
Обратите внимание на то, что номер группы у элементов главной подгруппы
показывает число электронов на внешней оболочке. У кислорода на внешней
оболочке 6 электронов (элемент 6 группы главной подгруппы).
|